-
業種・地域から探す
海外にも活躍の場 医薬品 最前線
エーザイと米バイオジェン・インクが共同開発した早期アルツハイマー病(AD)治療薬「レカネマブ」が1月、米国食品医薬品局(FDA)から迅速承認された。認知機能の低下を遅らせる効果を臨床試験で明確に示した薬として話題となった。また、予後の悪い難治性がんである胆管がんの治療薬「フチバチニブ」について、大塚ホールディングス(HD)が2022年10月、米FDAから承認を取得した。いずれも期待の新薬となる。
認知機能 低下抑える エーザイ共同開発
レカネマブはADによる軽度認知障害、または軽度認知症の患者が対象。ADの病理に作用する治療薬の迅速承認は、同じくエーザイとバイオジェンが開発した「アデュカヌマブ」に続く2例目となる。アデュカヌマブは日本ではまだ承認には至っていない。
レカネマブはAD当事者の認知機能や、日常生活の動作全般をより長く維持できると期待されている。臨床症状の悪化を抑制することで、標準治療よりも疾患の進行を平均約3年間遅らせるとエーザイは推定する。
迅速承認は、ADの特徴である脳内に蓄積した「Aβプラーク」の減少効果を示した第2相臨床試験の結果に基づく。すでに大規模なグローバル第3相臨床試験のデータに基づき、フル承認に向けてFDAへ申請した。中国でも承認に向けデータを提出したほか、1月中に日本と欧州でも承認申請を行った。
エーザイの内藤晴夫最高経営責任者(CEO)は「当事者とその家族にインパクトのある結果をもたらす可能性がある」と自負する。レカネマブの米国での発売価格は年2万6500ドル(約350万円)。米国ではすでに発売しており、「予想を上回る推移」(アイヴァン・チャン常務執行役)だという。
ADは慢性、かつ進行性で心身に障害を引き起こす致死性疾患。世界保健機関(WHO)の調査で認知症は世界の病死の原因第7位であり、米国疾病予防管理センター(CDC)によると、ADは認知症の原因の第1位だ。AD診断後の平均生存期間は一般的に3ー11年とされる。
独自基盤活用 新薬を開発―大鵬薬品
-
世界初の共有結合型FGFR阻害薬「フチバチニブ」(大鵬薬品工業提供)
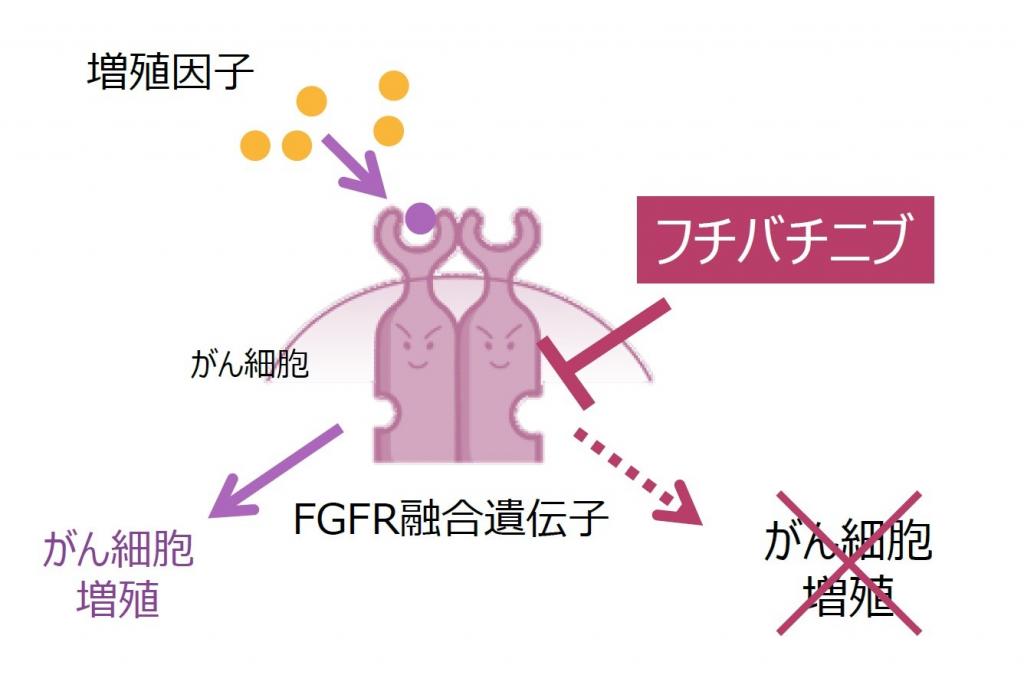
大塚HD傘下の大鵬薬品工業(東京都千代田区、小林将之社長)が創製したFGFR(線維芽細胞増殖因子受容体)阻害剤フチバチニブは、化学療法などの前治療歴を持つ切除不能な局所進行、または転移性肝内胆管がんの経口治療薬だ。
米子会社大鵬オンコロジーを通じ、いまだ埋められない「アンメット・メディカル・ニーズ」を満たす医薬品として、第2相臨床試験の結果に基づく迅速承認下で承認された。試験では全身療法の治療歴のある患者を対象に、病勢進行、または許容できない毒性が認められるまで、1日1回フチバチニブを経口投与した。日本でも承認申請済みだ。
胆管がんはまれで治療が難しい疾患。米国では、毎年約8000人が胆管がん(肝内、肝外含む)と診断される。胆管がんと診断された患者の約20%は肝内型で、このうち約10-16%の患者に、腫瘍増殖を促すFGFR2遺伝子再構成が認められる。
大鵬薬品は創薬の標的となるたんぱく質中の特定のアミノ酸(主にシステイン)を認識し、共有結合する独自の「システイノミクス創薬」基盤を持つ。フチバチニブはこの基盤を用いた新薬第1号となった。
同社は22年、創薬の生産性向上に向け、新薬の候補となる化合物を自動合成するロボットをつくば研究所(茨城県つくば市)に導入している。化合物候補をロボットで網羅的に合成し、化合物群(ライブラリー)を効率的に構築することで社内データベースの精度を高め、創薬の成功率を高めるのが狙い。約2年後をめどに精製工程にも導入し、スクリーニングまで一貫した自動化体制を整える。
EUでデング熱ワクチン承認取得―武田薬品
武田薬品工業はデング熱ワクチン「キューデンガ」(4価弱毒生デング熱ワクチン)について、インドネシア国内に加え、欧州連合(EU)での使用について承認を取得した。米国でも申請し、米国食品医薬品局(FDA)より優先審査に指定された。同社にとって国外で初めて販売するワクチンになる。
キューデンガは4種すべてのデングウイルス血清型により引き起こされるデング熱の予防が目的。デングウイルスの感染歴を調べるワクチン接種前検査を必要としない。
同ワクチンは、22年8月にインドネシア国家医薬品食品管理庁(BPOM)から承認を取得した。デング熱ワクチンはほかに15年に世界で初めて承認された仏サノフィのワクチンがあるが、インドネシアで承認されたのは初めて。接種対象は6歳ー45歳で順次、現地で接種される。
近年、インドネシアには東南アジアのデング熱感染者のほぼ半数が集中している。22年1ー6月の感染者は6万3000人超で、約600人が死亡したとの報告がある。
さらに12月には、4歳以上を接種対象として、欧州委員会(EC)からEUでの使用について承認を取得した。デング熱ワクチンはEUでも初の承認となる。デング熱の流行国であるラテンアメリカやアジア地域でも審査が進行中だ。
グローバル臨床第3相試験では、小児と若年層の被験者を対象に、キューデンガを2回接種した際の安全性と有効性を評価。4年半にわたって追跡調査を行った。
デング熱は蚊が媒介するウイルス性疾患で、気候変動と都市化により世界の発生率は過去20年間で8倍に上昇している。年齢や健康状態を問わず、流行地域の住民や旅行者なら誰でも感染のリスクがある。
武田薬品は新型コロナウイルス感染症やインフルエンザ、ジカウイルスなどの感染症に対するワクチンを開発しており、今後もグローバルワクチンの提供を加速していく。

